NAMA : NURLAILI
NIM : A1C114021
1. Senyawa organik dan namanya
CH3 - CH2 - CH2 - CH3 = butana
2. Alkil halida dan namanya
CH3 - CH2 - Cl = 1-kloro etana
3. Alkil halida dan namanya
4. Senyawa organik tak jemuh
CH3 - CH = CH - CH3 = Butena
5. Senyawa organometalik
CH3 - CH2 - CH2 - CH2 - MgBr = 1-Magnesium Bromida Butana
6. Jenis Monosakarida
7. Jenis disakarida
Struktur Laktosa
Rabu, 16 Maret 2016
Rabu, 09 Maret 2016
MONOSAKARIDA
TUGAS PORTOPOLIO KIMIA ORGANIK II
Menentukan jenis variasi struktur C4 dan C5 (monosakarida) dan mana yang paling berharga/penting. Minimal 5 struktur !
Jawaban :

Menentukan jenis variasi struktur C4 dan C5 (monosakarida) dan mana yang paling berharga/penting. Minimal 5 struktur !
Jawaban :
- C4
Struktur dari C4
- C kiral yang dimiliki C4 (tetrosa)
C4 memiliki 2 atom kiral seprti gambar berikut :
- Variasi struktur dari C4
Variasi struktur dari C4 dapat ditentukan dari jumlah atom kiral yang dimiliki dengan rumus 2 pangkat n. sehingga pada C4 memiliki 4 variasi struktur. Karean variasi struktur pada soal dibuat 5, hal ini tidak bisa dilakukan. Hal ini berdasarkan teori jumlah variasi struktur 2^n sedangkan nilai n pada C4 adalah 2 sehingga variasi strukturnya hanya 4.

- struktur yang paling penting/berharga adalah ylulosa. Gula ini tidak banyak ditemui, walaupun beberapa bentuk berperan dalam proses fotosintesis dan respirasi.
- C5
Struktur dari C5 adalah sebagai berikut :
- C kiral yang dimiliki C5 (pentosa)
C4 memiliki 3 atom kiral seprti gambar berikut :
- Variasi struktur dari C5
Variasi struktur dari C5 dapat ditentukan dari jumlah atom kiral yang dimiliki dengan rumus 2 pangkat n. sehingga pada C5 memiliki 8 variasi struktur. Hal ini berdasarkan teori jumlah variasi struktur 2^n sedangkan nilai n pada C5 adalah 3 sehingga variasi strukturnya hanya 4. Hal ini memenuhi kriteria pada soal.
Rabu, 02 Maret 2016
Tugas Portofolio
1. Rancanglah suatu ikatan karbon-karbon dimana reagen pembentuknya sekunder dan tersier !
Jawaban :
Reaksi yang terjadi pada senyawa organologam bisa dibilang sangat kompleks Karena melibatkan reaksi-reaksi ligan organik dan bagaimana ligan tersebut berikatan dengan atom logam. Aplikasi senyawa organologam yang mungkin paling menonjol adalah sebagai katalis. Sebagai contoh apabila kita memiliki senyawa organik A dan B, dimana kita berkeinginan untuk menggabungkan rantai karbon milik A dan B. Agar kedua senyawa tersebut dapat bergabung maka dibutuhkanlah suatu katalis organologam dimana dia akan melakukan berbagai macam reaksi sampai senyawa A dan B bisa bergabung dan katalis itu sendiri akan melepaskan diri.
Jawaban :
Reaksi yang terjadi pada senyawa organologam bisa dibilang sangat kompleks Karena melibatkan reaksi-reaksi ligan organik dan bagaimana ligan tersebut berikatan dengan atom logam. Aplikasi senyawa organologam yang mungkin paling menonjol adalah sebagai katalis. Sebagai contoh apabila kita memiliki senyawa organik A dan B, dimana kita berkeinginan untuk menggabungkan rantai karbon milik A dan B. Agar kedua senyawa tersebut dapat bergabung maka dibutuhkanlah suatu katalis organologam dimana dia akan melakukan berbagai macam reaksi sampai senyawa A dan B bisa bergabung dan katalis itu sendiri akan melepaskan diri.
Selasa, 01 Maret 2016
Senyawa Organometalik
Senyawa organologam adalah senyawa
di mana atom-atom karbon dari gugus organik terikat kepada atom logam. Contoh, suatu
aloksida seperti (C3H7O)4Ti tidaklah dianggap
sebagai suatu senyawa organologam karena gugus organiknya terikat pada Ti
melalui oksigen, sedangkan C6H5Ti(OC3H7)3
karena terdapat satu ikatan langsung antara karbon C dari gugus fenil
dengan logam Ti.HH Istilah organologam biasanya didefenisikan agak
longgar, dan senyawaan dari unsur-unsur seperti Boron, fosfor, dan silikon
semuanya mirip logam. Tetapi untuk senyawa yang mengandung ikatan antara
atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen
tidak termasuk sebagai senyawa organologam. Dari bentuk ikatan pada senyawa
organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik
dan anorganik.
Sifat senyawa organologam yang umum ialah atom karbon yang lebih elektronegatif daripada kebanyakan logamnya. Senyawa komplek logam (biasanya logam-logam transisi) merupakan senyawa yang memiliki satu atau lebih ikatan logam-karbon. Senyawa organologam terdiri dari atom pusat dan ligan.
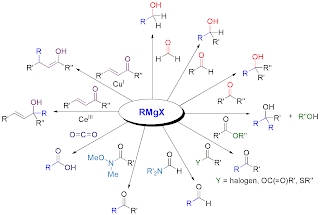
Reaksi
Grignard adalah contoh reaksi senyawa organologam. Karena berbagai
jenis aldehida dan keton mudah didapat, berbagai senyawa organik dapat
disintesis dengan bantuan reaksi Grignard.
Sifat senyawa organologam yang umum ialah atom karbon yang lebih elektronegatif daripada kebanyakan logamnya. Senyawa komplek logam (biasanya logam-logam transisi) merupakan senyawa yang memiliki satu atau lebih ikatan logam-karbon. Senyawa organologam terdiri dari atom pusat dan ligan.
Reaksi Grignard ditemukan oleh kimiawan
Perancis Auguste Victor Grignard (1871-1935) di tahun 1901. Tahap awal
reaksi adalah reaksi pembentukan metil magnesium iodida, reagen
Grignard, dari reaksi antara alkil halida (metil iodida dalam contoh di
bawah ini) dan magnesium dalam dietil eter kering.
CH3I + Mg –> CH3MgI
Anda
pasti melihat bahwa magnisium terikat langsung dengan karbon. Senyawa
semacam ini yang sering disebut sebagai reagen Grignard dengan ikatan
C-logam dimasukkan dalam golongan senyawa organologam. Ikatan C-logam
sangat labil dan mudah menghasilkan karbanion seperti CH3-
setelah putusnya ikatan logam-karbon. Ion karbanion cenderung menyerang
atom karbon bermuatan positif. Telah dikenal luas bahwa atom karbon
gugus aldehida atau gugus keton bermuatan positif karena berikatan
dengan atom oksigen yang elektronegatif. Atom karbon ini akan diserang
oleh karbanion menghasilkan adduct yang akan menghasilkan alkohol
sekunder dari aldehida atau alkohol tersier dari keton setelah
hidrolisis.
C6H5CHO + CH3MgI –> C6H5CH(CH3)OMgI
- Reaksi dengan karbonil
- Reaksi dengan senyawa elektrofilik lainnya
Rabu, 24 Februari 2016
Reaksi Adisi
Reaksi Adisi adalah reaksi penambahan suatu atom pada ikatan
rangkap dalam suatu senyawa. Reaksi adisi terjadi pada senyawa yang mempunyai ikatan rangkap dua atau rangkap tiga, senyawa alkena atau senyawa alkuna, termasuk ikatan rangkap karbon
dengan atom lain. Dalam reaksi adisi, molekul senyawa yang mempunyai ikatan
rangkap menyerap atom atau gugus atom sehingga ikatan rangkap berubah menjadi
ikatan tunggal.
Alkena dan alkuna dapat mengalami reaksi adisi dengan
hidrogen, halogen maupun asam halida (HX). Untuk alkena atau alkuna, bila jumlah atom H pada
kedua atom C ikatan rangkap berbeda, maka arah adisi ditentukan oleh kaidah
Markovnikov, yaitu atom H akan terikat pada atom karbon yang lebih banyak atom
H-nya. (Pada reaksi ini berlaku hukum Markovnikov ”Atom H dari asam halide
ditangkap oleh C berikatan rangkap yang mengikat atom H lebih banyak atau
gugus alkil yang lebih kecil).
contoh reaksi adisi yaitu
Konformasi Alkana
Bila alkana yang mempunyai 2 atau lebih atom karbon diputar mengelilingi garis ikatan karbon-karbon maka akan menghasilkan tatanan 3 dimensi yang berbeda-beda. Setiap tatanan 3 dimensi atom-atom yang dihasilkan oleh rotasi pada sumbu ikatan tunggal disebut konformasi.
Contohnya, molekul etana yang digambarkan dengan proyeksi Newman. Yang dimaksud gambar proyeksi Newman adalah gambar molekul yang diperoleh dengan cara memandang molekul tersebut dari arah sumbu ikatan karbon-karbon.
Bila alkana yang mempunyai 2 atau lebih atom karbon diputar mengelilingi garis ikatan karbon-karbon maka akan menghasilkan tatanan 3 dimensi yang berbeda-beda. Setiap tatanan 3 dimensi atom-atom yang dihasilkan oleh rotasi pada sumbu ikatan tunggal disebut konformasi.
Contohnya, molekul etana yang digambarkan dengan proyeksi Newman. Yang dimaksud gambar proyeksi Newman adalah gambar molekul yang diperoleh dengan cara memandang molekul tersebut dari arah sumbu ikatan karbon-karbon.
 |
| Proyeksi Newman molekul etana |
Apabila dilakukan pemutaran mengelilingi sumbu ikatan C-C berturut-turut
sebesar 60, 120, 180, 240, dan 300 derajat maka diperoleh konformasi
sebagai berikut
Apabila diamati keenam konformer tersebut ternyata hanya terdapat 2 konformer yang ekstrem yaitu konformasi goyang (staggered) dan eklips (eclipsed). Konformasi "goyang" dan "eklips" ditunjukkan oleh gambar dibawah ini
Pada konformasi "goyang", ketiga ikatan C-H pada atom karbon yang satu berjauhan dengan tiga ikatan C-H pada atom karbon yang berdampingan. Sebaliknya pada konformasi "eklips", ketiga ikatan C-H pada atom karbon yang satu berdekatan dengan tiga ikatan C-H atom karbon yang berdampingan.
Jika pada contoh reaksi adisi (tugas portofolio) diatas dikonformasikan, maka akan stabil pada sudut 0, 120, 240 dan 360 derajat Celsius. berikut di berikan contoh gambar proyeksi pada sudut 0 derajat celsius.
Sabtu, 13 Februari 2016
Reaksi Eliminasi Pada Alkil Halida
Jika alkil halida mempunyai atom hidrogennya pada
atom karbon yang bersebelahan dengan karbon pembawa halogen akan bereaksi
dengan nukleofil, maka
terdapat dua kemungkinan reaksi yang bersaing, yaitu substitusi dan eliminasi.
Pada
reaksi substitusi, nukleofil menggantikan halogen (lihat pers. 5.5). Pada reaksi
eliminasi (pers. 5.6), halogen X dan hidrogen dari atom karbon yang bersebelahan
dieliminasi dan ikatan baru terbentuk di antara karbon-karbon
yang pada mulanya membawa X dan H. Proses eliminasi adalah cara umum
yang
digunakan dalam pembuatan senyawa-senyawa yang mengandung ikatan rangkap.
Seringkali reaksi substitusi dan eliminasi terjadi secara bersamaan pada pasangan
pereaksi nukleofil dan substrat yang sama. Reaksi mana yang dominan, bergantung
pada kekuatan nukleofil, struktur substrat, dan kondisi reaksi. Seperti halnya
dengan reaksi substitusi, reaksi elimanasi juga mempunyai dua mekanisme, yaitu
mekanisme E2 dan E1.
Mekanisme
E2
Reaksi E2 adalah proses satu tahap. Nukleofil
bertindak sebagai basa dan mengambil
proton (hidrogen) dari atom
karbon yang bersebelahan dengan karbon pembawa
gugus pergi. Pada waktu yang
bersamaan, gugus pergi terlepas
dan ikatan rangkap dua terbentuk.
Konfigurasi yang terbaik untuk reaksi E2 adalah
konfigurasi dimana hidrogen yang akan tereliminasi dalam posisi anti dengan gugus pergi. Alasannya ialah bahwa
pada posisi tersebut orbital ikatan C-H dan C-X tersusun sempurna yang
memudahkan pertumpangtindihan orbital dalam pembentukan ikatan baru.
Mekanisme
E1
Mekanisme E1 mempunyai tahap awal yang sama dengan
mekanisme SN1. Tahap lambat atau penentuan ialah tahap ionisasi dari substrat
yang menghasilkan ion karbonium (bandingkan dengan pers. 5.3).
Kemudian, ada dua kemungkinan reaksi untuk ion karbonium. Ion bisa bergabung dengan nukleofil (proses SN1) atau atom karbon bersebelahan dengan ion karbonium melepaskan protonnya, sebagaimana ditunjukkan dengan panah lengkung, dan membentuk alkena (proses E1).
Kemudian, ada dua kemungkinan reaksi untuk ion karbonium. Ion bisa bergabung dengan nukleofil (proses SN1) atau atom karbon bersebelahan dengan ion karbonium melepaskan protonnya, sebagaimana ditunjukkan dengan panah lengkung, dan membentuk alkena (proses E1).
Sekarang mari kita lihat dengan contoh-contoh
bagaimana reaksi-reaksi substitusi dan eliminasi bersaing.
PERSAINGAN
SUBSTITUSI DAN ELIMINASI
Ditinjau reaksi antara alkil halida dengan kalium
hidroksida yang dilarutkan
dalam
metil alkohol. Nukleofilnya adalah ion hidroksida, OH-, yaitu nukleofil kuat dan
sekaligus adalah basa kuat. Pelarut alkohol kurang polar jika dibandingkan dengan
air. Keadaan-keadaan ini menguntungkan proses-proses SN2 dan E2 jika dibandingkan
dengan SN1 dan E1. Misalnya, gugus alkil pada alkil halida adalah primer, yaitu
1-bromobutana. Kedua
proses dapat terjadi.
Hasilnya
adalah campuran 1-butanol dan 1-butena. Reaksi SN2 cenderung terjadi jika digunakan
pelarut yang lebih polar (air), konsentrasi basa yang sedang, dan suhu sedang.
Reaksi E2, cenderung terjadi jika digunakan pelarut yang kurang polar, konsentrasi
basa yang tinggi, dan suhu tinggi.
Seandainya kita mengganti alkil halida primer
menjadi tersier, reaksi substitusi akan terhambat (ingat, urutan reaktivitas
untuk reaktivitas SN2 adalah 10 >20 >> 30).
Tetapi, reaksi eliminasi akan cenderung terjadi karena hasilnya adalah alkena
yang lebih tersubtitusi. Pada kenyataannya, dengan t-butil bromida, hanya proses E2
yang terjadi.
Jadi, bagaimana kita mengubah butil bromida tersier
menjadi alkoholnya? Kita tidak menggunakan ion hidroksida, melainkan air. Air merupakan
basa yang lebih lemah daripada ion hidroksida, sehingga reaksi E2 ditekan. Air
juga merupakan pelarut polar, yang menguntungkan mekanisme ionisasi. Dalam hal
ini, E1 tidak dapat dihindari sebab persaingan antara E1 dan SN1 cukup berat.
Hasil utama adalah hasil subtitusi (80%), tetapi eliminasi masih terjadi (20%).
Hasil utama adalah hasil subtitusi (80%), tetapi eliminasi masih terjadi (20%).
Ringkasannya, halida
tersier bereaksi dengan basa kuat dalam pelarut nonpolar memberikan eliminasi
(E2), bukan subtitusi. Dengan basa lemah dan nukleofil lemah, dan dalam pelarut
polar, halida tersier memberikan hasil utama subtitusi (SN1), tetapi sedikit
eliminasi (E1) juga terjadi. Halida primer bereaksi hanya melalui mekanisme-mekanisme
SN2 dan E2, karena mereka tidak terionisasi menjadi ion karbonium. Halida
sekunder menempati kedudukan pertengahan, dan mekanisme yang terjadi sangat dipengaruhi oleh keadaan reaksi. Halida-halida sekunder dapat bereaksi melalui mekanisme SN1 dan SN2 secara serentak.
Langganan:
Postingan (Atom)